Para informar sobre el inicio de la Fase III de Soberana 02, los preparativos de la Fase III de Abdala y otros detalles de interés sobre los candidatos vacunales cubanos contra la COVID-19, directivos de Biocubafarma, el Instituto Finlay de Vacunas, el Centro de Ingeniería Genética y Biotecnología y el Instituto de Medicina Tropical Pedro Kouri participan este viernes en la Mesa Redonda.
Cuba posee cinco candidatos vacunales en desarrollo clínico
Pérez Rodríguez comentó que Cuba posee cinco candidatos vacunales en desarrollo clínico. Foto: Roberto Garaicoa.
La entrada del primer candidato vacunal (Soberana 02) a la tercera fase de ensayos clínicos, tras la aprobación de la agencia regulatoria cubana, es un hito importante, convirtiéndose en la primera vacuna desarrollada en América Latina en llegar a esta etapa, destacó al iniciar su intervención en el programa televisivo el Dr. Rolando Pérez Rodríguez, director de Ciencia e Innovación de BioCubaFarma.
“Esperamos que en el mes de marzo el candidato vacunal Abdala reciba la autorización de la agencia reguladora para iniciar esta fase”, dijo.
Pérez Rodríguez comentó que Cuba posee cinco candidatos vacunales en desarrollo clínico: Soberana 01, Soberana 02, Abdala, Mambisa y Soberana Plus, de reciente incorporación. Esta última es una de las formulaciones evaluadas en el proyecto de Soberana 01, “pero que se desarrollará como una vacuna de refuerzo y se utilizará en pacientes convalecientes o en combinación con otras vacunas”.
El programa de vacuna de Cuba comenzó en mayo de 2020 y los estudios clínicos comenzaron en agosto. En este período se han logrado avances sustanciales, destacó el doctor, tomando en cuenta la entrada de un candidato vacunal a la fase tres y otro que se prevé pase a esa etapa en este mes.
Hasta la fecha se han vacunado tan solo el 2,13% de la población mundial
Sobre el desarrollo de vacunas en otros países, el doctor explicó que existen 308 candidatos vacunales, de ellos 81 en ensayos clínicos y 16 en fase tres. “De manera que Soberana 02 y Abdala serían los candidatos 17 y 18 en comenzar la fase III de ensayo clínico a nivel mundial”.
Excepto los candidatos de India, una economía emergente, y China, el resto de los que se encuentran en esta fase pertenecen a las grandes trasnacionales de países desarrollados.
Según la Organización Mundial de la Salud (OMS), 15 vacunas cuentan ya con registros sanitarios o autorización de uso de emergencia. “En general, las vacunas aprobadas tienen un esquema de dos dosis, aunque se evalúan otras con esquema de tres dosis”.
Hasta el cuatro de marzo se han administrado en el mundo 284 millones de dosis de vacunas, y han recibido al menos una dosis, 166 millones de sujetos (en 81 países), lo que representa un 2,13% de la población mundial.
Reportan que 60 millones de personas han recibido el ciclo completo de inmunización, lo que representa un 0,78% de la población mundial. “Se trata de un desafío enorme, porque cortar la transmisión del virus en el mundo implica una cobertura grande de la población total vacunada”.
Las primeras evidencias del impacto de la vacunación en el control de la pandemia se han obtenido en Israel, país pequeño que ya tiene un porcentaje relativamente alto de su población vacunada, comentó Pérez Rodríguez.
Los primeros datos de efectividad de esta vacunación masiva indican que se logra reducir del 66 al 85% los casos positivos a la COVID-19, mientras que los casos graves y críticos se reducen en un 90%. “Habrá una reducción clara de la letalidad, pero aún no está muy claro el impacto que habrá en la transmisión”.
“Debemos entender que las vacunas llevan mucho tiempo para evaluarse, porque es necesario ver la protección a largo plazo y cuánto dura la inmunidad. Pero ante la urgencia de desarrollar las vacunas para enfrentar la pandemia se ha tenido que acelerar todo el proceso”.
El doctor argumentó que se siguen acumulando evidencias y se generan nuevos conocimientos durante la extensión de estas vacunas, que permitirán ir perfeccionando las estrategias de inmunización en los próximos meses.
¿Cómo se llega a la fase tres de ensayos clínicos?
El criterio utilizado, equivalente a esa inmunidad protectiva, es la inducción de anticuerpos neutralizantes. Foto: Roberto Garaicoa.
¿Cómo se llega a la fase tres de ensayos clínicos? Pérez Rodríguez puntualizó que se hace un primer ensayo pequeño que mide esencialmente la seguridad e inmunogenicidad del candidato. Después, el ensayo fase II amplía las evidencias de seguridad y permite comprobar que esa respuesta inmune tiene una funcionalidad.
El criterio utilizado, equivalente a esa inmunidad protectiva, es la inducción de anticuerpos neutralizantes.O sea, se hace una prueba de laboratorio donde se usan células en cultivo que se infectan con el virus, así como se utiliza el suero de los pacientes vacunados. “Si ese suero tiene anticuerpos que impiden que el virus puede infectar las células, entonces es porque hay anticuerpos neutralizantes”.
En la práctica, en las vacunas que han llegado a fase III y que han demostrado eficacia, se ha confirmado que inducen anticuerpos neutralizantes, equivalentes a los anticuerpos que existen en pacientes convalecientes. “Cuando uno enferma se desarrolla una inmunidad natural contra el virus, y eso es lo que permiten las vacunas”.
“Los conocimientos generados previamente permiten que los proyectos que se están desarrollando, que entran en fase III, si tienen una fase II en la que se logra demostrar que se induce respuesta de anticuerpos neutralizantes similar a los pacientes convalecientes, entonces es probable que la vacuna tendrá efectividad en reducir la tasa de incidencia de la enfermedad de pacientes graves y críticos”, detalló Pérez Rodríguez.
Argumentó que las vacunas que obtuvieron una autorización de uso han mostrado una eficacia entre un 70 y 90%, quiere decir que reduce la tasa de incidencia de la enfermedad en ese porcentaje. No obstante, la OMS plantea que una reducción de hasta 50% sería de utilidad, porque tendría un impacto en el manejo de la enfermedad y por tanto sería reconocida por esta organización.
“No hay forma de vacunar a toda la población mundial con unos pocos candidatos vacunales, por eso es necesario continuar el desarrollo de diferentes vacunas. Siempre que existan vacunas con más de un 50% de eficacia, la variedad ayudará a controlar la pandemia a nivel global”.
El experto explicó que en el desarrollo de los proyectos se ha ido “sobrelapando las fases de ensayos clínicos”. “En la fase I, por ejemplo, una vez que se tiene las evidencias de seguridad y las primeras evidencias de inmunogenicidad, se solicita pasar a la fase II aunque continúe el seguimiento de pacientes, semanas o meses, para ver si aparecen reacciones tardías adversas”.
La agencia reguladora cubana ha exigido el cumplimiento estricto de todas las regulaciones con el objetivo de garantizar la seguridad de los voluntarios y que existan todas las evidencias que posibiliten el tránsito hacia la fase siguiente.
También se ha seguido las recomendaciones de la OMS y las diferentes agencias reguladoras del mundo.
Las publicaciones de los resultados de los ensayos cubanos ya empiezan a aparecer. Se han ido tomando las decisiones de tránsito, pero en cada fase continúan los exámenes y análisis de laboratorios para completar todos sus requerimientos técnicos.
Por ejemplo, hay una de Soberana 02, con todos los datos preclínicos; otra con los resultados del ensayo clínico fase uno con Soberana Plus. También se preparan las publicaciones de los resultados de las fases uno de Soberana 01, Soberana 02, y Abdala.
“En las próximas semanas irán apareciendo las publicaciones, es un proceso que no parará, pero que ha llevado tiempo para completar la data necesaria para que la publicación fuera lo suficientemente convincente”, destacó.
Soberana 02: Principales resultados
Sobre el paso de las vacunas a la Fase III de ensayos clínicos, la Dra. Dagmar García Rivera, Directora de Investigaciones del Instituto Finlay de Vacunas, rememoró la evolución de Soberana 02 durante nueve meses de intenso trabajo.
Recordó que, en mayo de 2020, Cuba comenzó a definir cómo sería la vacuna. “Luego, el 24 agosto comenzamos el primer ensayo clínico con dos formulaciones de Soberana 01. En octubre, Soberana 02 inició su fase I, en diciembre la fase II y el 3 de marzo recibimos la autorización de la fase III para demostrar eficacia clínica”.
Esto ha sido posible por varias razones señaladas en otras oportunidades. Ha sido de vital importancia la alianza estratégica organizada entre muchas instituciones del país, tanto de Biocubafarma como del Ministerio de Salud Pública (Minsap).
“Si no hubiera sido porque cada institución puso su mejor capacidad científico tecnológica en función de las vacunas, no hubiéramos podido avanzar tanto en solo 9 meses”, destacó la investigadora.
Respecto a la organización de cada fase, comentó que la primera de ellas tuvo a 40 sujetos, la segunda a 910 y la tercera, inicia en La Habana con 44 mil personas. Esta ampliación de las muestras está directamente relacionada con la seguridad de los candidatos vacunales.
“Aunque trabajamos sobre una plataforma ya conocida y probada, es de rigor probar la confiabilidad durante cada fase”, insistió.
En tal sentido, refirió que de los 40 sujetos que tomaron parte en la fase I, 16 reportaron algún evento adverso leve, sobre todo enrojecimiento o dolor en el área de la vacunación. En el caso de la fase II, el 59.4% refirió un evento adverso, aunque en el 40% de ellos solo fue dolor leve en el sitio de vacunación. En ninguna fase se reportan reacciones graves.
Por otra parte, en lo relativo a la inmunogenicidad, durante la fase I el 84% de los sujetos se consideraron “respondedores”.
A partir de esos indicadores, se decidió aplicar una tercera dosis dividiendo la muestra en dos grupos: a la mitad se le puso Soberana 02 y al resto Soberana Plus. Después de esta tercera dosis, la totalidad de los sujetos son “respondedores” y el 90% desarrolló anticuerpos contra el virus. Entre el 60 y el 65% también demostró respuestas específicas a las células T.
Durante la fase II, después de dos dosis de la vacuna, el 81% de las personas tuvieron una respuesta positiva, un indicador que sube al 96% después de la tercera dosis. De igual modo, el 76% desarrolló anticuerpos neutralizantes tras la segunda dosis.
“Sobre la base de estos resultados solicitamos la autorización para comenzar la siguiente etapa con este candidato”, destacó García Rivera.
La especialista apuntó que, durante cada etapa del proceso, los desarrolladores no tomaron parte en el procesamiento de las muestras de los sujetos en estudio. “Esta evaluación externa significa una fortaleza de cara a la auditoría y reconocimiento de esta vacuna a nivel internacional”, agregó.
Abdala: A las puertas de la Fase III
Junto a Soberana 02, el desarrollo del candidato vacunal Abdala abre puertas para el combate contra la COVID-19. Al respecto, la Dra. Verena Muzio González, directora de Investigaciones Clínicas del Centro de Ingeniería Genética y Biotecnología (CIGB), explicó que se basa en la misma plataforma utilizada para crear la vacuna recombinante contra la Hepatitis B.
“En solo tres meses hemos desarrollado las fases I y II, gracias también a la colaboración entre las entidades científicas”.
Los estudios se diseñaron para probar dos esquemas de vacunación: uno largo y uno corto. El esquema corto incluye tres dosis cada 14 días, mientras que el largo implica recibir la vacuna cada 28 días.
“Esto lo hicimos no solo para probar la eficacia del fármaco, sino para evaluar dos niveles de dosis y tener alternativas ante posibles cambios. Entonces descubrimos que en el esquema corto los mejores resultados los tuvieron las altas dosis”, explicó la investigadora.
Se demostró también que más del 60% de las personas desarrollaron niveles de inhibición. Al terminar la tercera dosis, el 95% tenían anticuerpo incrementados más de cuatro veces en relación al momento del inicio del estudio. “Con estos resultados propusimos comenzar el ensayo en fase III”.
Cuba cuenta con 320 mil dosis de Soberana 02
Sobre el paso de las vacunas a la Fase III de ensayos clínicos, la Dra. Dagmar García Rivera, Directora de Investigaciones del Instituto Finlay de Vacunas, rememoró la evolución de Soberana 02 durante nueve meses de intenso trabajo. Foto: Roberto Garaicoa.
En otro momento de la emisión, la Dra. Dagmar García Rivera informó que el país ya cuenta con 320 mil dosis de Soberana 02, dividida en tres lotes. Cada parte del proceso —dijo— tiene la inspección de las autoridades reguladoras, lo que fortalece la voluntad de no comprometer cualquier parte del proceso.
La Habana será la sede de los estudios de fase III de Soberana 02, una experiencia que implica una alta organización y el apoyo de instituciones científicas y universidades. En tal sentido, la especialista apuntó que el proceso ocurre en ocho municipios de la capital.
“Esto no no implica que ya empezó la vacunación”, precisó.
Asimismo, elogió el papel de los jóvenes universitarios en el procesamiento de la información y en la coordinación de procesos. Nuestro propósito es convertir a La Habana en un gran sitio clínico para Soberana 02, concluyó.
¿Cuáles son las características del ensayo clínico fase III de Soberana 02?
La Dra. C. María Eugenia Toledo Romaní, investigadora principal del ensayo clínico Soberana 02.
Al intervenir en la Mesa Redonda de este viernes, la Dra. C. María Eugenia Toledo Romaní, investigadora principal del ensayo clínico Soberana 02, del Instituto de Medicina Tropical Pedro Kourí (IPK), comentó que este ensayo fase III con el candidato vacunal representa el mayor reto metodológico y operacional al que se enfrentan ahora, a punto de clasificar el estudio dentro de las denominadas intervenciones complejas.
“Dicha complejidad no viene dada por el hecho de incluir una amplia muestra de más de 44 000 sujetos. Es un ensayo complejo porque tenemos importantes retos científicos. Uno de ellos es demostrar que el candidato vacunal cumple con las expectativas y las exigencias, no solamente de la agencia reguladora nacional sino de las agencias internacionales.
“Estas últimas están observando cómo Cuba entra en una fase III, siendo un país pobre; y sobre todo cómo va a cumplir con esta etapa teniendo como prioridad los principios de buenas prácticas y de involucrar a la población con su propio consentimiento”, dijo la experta.
Asimismo, es una intervención compleja porque se trata de un estudio multicéntrico que ha tenido que salir de los límites de los grandes instituciones y hospitales para abarcar la atención primaria de salud y poder involucrar y formar equipos que, entrenados, puedan cumplimentar todos los procesos que ha concebido el estudio.
“Pero sobre todo es compleja porque en medio de una pandemia tenemos el reto de hacerla, y hacerla bien”, aseveró Toledo Romaní.
De acuerdo con la especialista, este es un estudio adaptativo. Se realizarán evaluaciones en diferentes momentos del estudio, para determinar si realmente hay diferencias entre los individuos que reciben el candidato vacunal y quienes reciben el placebo.
“Que sea un estudio controlado con placebo es un elemento importante que debe conocerse. Es una exigencia internacional, además, demostrar que hay diferencias entre los sujetos que reciben el candidato vacunal y aquellos que no. El placebo será indistinguible del candidato vacunal y lo único que no va a contener es el RBD del virus.
“Es un ensayo a ciegas, porque ni quienes recibieron la vacuna, ni quienes la administran, ni quienes hacen las evaluaciones saben cómo estuvieron los sujetos incluidos en cada grupo. Pero todos los sujetos van a recibir información de cuáles son sus beneficios de participación en el estudio, porque de todas formas serían beneficiados con la vacunación una vez que el estudio concluya”, refirió Toledo Romaní.
Lo más importante de este ensayo es evaluar la eficacia
Lo más importante de este ensayo es evaluar la eficacia clínica, insistió. En ese sentido, la población debe saber que se compararán dos esquemas de tratamiento: un primero, que tiene dos dosis de Soberana 02 y un segundo, que tiene la posibilidad de incrementar significativamente la respuesta inmune, consistente en dos dosis del candidato vacunal Soberana 02 y una de Soberana 01A (Soberana Plus).
Según la experta, “en todas las vacunas que se han probado en el mundo, su principal variable y a la cual han apostado la eficacia, es a evitar la enfermedad sintomática. Es decir, a evitar que el individuo pase a formas graves de la enfermedad o fallezca y esa es también nuestra principal variable: evitar que las personas desarrollen una enfermedad sintomática por SARS-CoV-2”.
En estos estudios, otra exigencia que se mantiene es continuar realizando evaluaciones de la seguridad e inmunogenicidad del candidato vacunal.
De acuerdo con la especialista, estas evaluaciones comenzaron en dos sitios clínicos que han sido referencia de cómo las vacunas preventivas no tienen necesariamente que probarse en instituciones hospitalarias, sino en instalaciones de la atención primaria de salud que cumplan con el estándar de preparación del personal y de buenas prácticas. Es el caso de la Clínica 1 de La Lisa, y el policlínico 19 de abril, en Plaza de la Revolución. Estos estudios continuarán desarrollándose en los nuevos sitios clínicos.
Toledo Romaní apuntó que no se dejará de evaluar si es posible con la vacunación prevenir la infección, pero esta es una variable que necesita ser demostrada. “De ahí que seguimos diciendo que el candidato vacunal va a ser eficaz en prevenir la enfermedad, y si puede también prevenir la infección es un reto a demostrar”.
Al referirse a las características de la muestra y los sitios clínicos del estudio, señaló que se ha concebido para 44 mil 10 sujetos de manera general. Sin embargo, esta población ha sido estratificada teniendo en cuenta no solo la edad, sino también condiciones como las comorbilidades existentes, que constituyen riesgos para desarrollar complicaciones de la enfermedad.
De ahí que existirán para el ensayo tres estratos de población:
-Mayores de 65 años.
-Menores de 65 años sin riesgo de complicaciones.
-Menores de 65 años con riesgo de complicaciones.
“Estas definiciones y clasificaciones nos permitirán además comparar los resultados de la vacuna cubana con los de candidatos internacionales, que también han adoptado estas estratificaciones en la población”, señaló Toledo Romaní.
A juicio de la experta es esencial comprender que la Fase III, para que realmente sea válida, tiene que parecerse a la vida. Esto se traduce en parecerse a nuestras poblaciones, en términos de edad, y también de los riesgos.
¿Dónde se aplicará el ensayo?
Se han previsto un total de 30 sitios clínicos, que consisten en policlínicos seleccionados en los 8 municipios que abarca la intervención. Dentro de cada sitio clínico, aclaró, puede haber más de un vacunatorio, por lo que estos últimos suman 48.
“Alcanzar más de 44 000 sujetos en solo 30 días representa un inmenso reto en cuanto a cómo puede organizarse la población en estas condiciones para poder ser vacunada”, comentó.

La especialista subrayó que en los municipios seleccionados ya se había ido preparando el personal, y se ha desarrollado un proceso de identificación de los profesionales que podrían formar parte del estudio, de los consultorios que se van a involucrar, “en tanto le corresponde al área primaria de salud, como en ningún otro estudio poder seleccionar los sujetos, obtener su consentimiento y seguirlos”.
“De ahí que los equipos de la atención primaria de salud no son sólo colaboradores, sino miembros de este gran equipo de investigación”, señaló.
¿Quién puede vacunarse y quién no?
Una de las preocupaciones fundamentales de la población, dijo Toledo Romaní, es quién puede o no vacunarse.
Al respecto, mencionó los criterios de inclusión y exclusión concebidos. El primero de todos, dijo, es que la persona dé su consentimiento para participar. Se incluyen sólo sujetos comprendidos entre las edades de 19 y 80 años; en el caso de las mujeres que tengan disposición de no embarazarse durante el estudio (en tanto esta es una población especial en la que habría que demostrar que la vacuna no hace daño a la madre o futuro bebé).
Entre los criterios de exclusión del estudio están:
-Que el sujeto haya tenido una enfermedad febril o infecciosa aguda en los siete días previos a la administración de la vacuna o en el momento de su aplicación, esté tomando antibióticos por ello o tenga historia previa o actual de infección por SARS-CoV-2.
– Hiipersensibilidad al tiomersal, pues las vacunas tienen como preservante esta sustancia.
– La aplicación de vacunas que contengan anatoxina tetánica en los últimos tres meses.
– Mujeres que estén embarazadas, puerperio o lactancia, así como personas con enfermedades descompensadas que limiten la vacunación según criterio clínico.
– Hay otros criterios de exclusión como es el uso de inmunomoduladores, inmunosupresores o inmunoestimulantes.
“Sabemos que hay pacientes con enfermedades crónicas que usan este tipo de medicamentos, pero también se ha usado en la población Nasalferón y otros medicamentos que tienen efecto inmunomodulador. Entonces, si estos medicamentos han sido utilizados en los últimos 30 días por los sujetos no van a quedar incluidos en el estudio”, dijo la experta.
“Este elemento de enfermedad crónica descompensada será avalado por el médico de la familia y si necesita serlo por un médico de la atención secundaria debe ser documentado para definir que el sujeto se incluya o no”, explicó.
En relación a los grupos de tratamiento, apuntó que uno recibirá dos dosis (0 días y 28 días y luego se sigue hasta 3 meses luego de haber comenzado el esquema); un grupo placebo con dos dosis y el mismo seguimiento; y el grupo que recibirá tres dosis (dos de Soberana 02 y una de Soberana Plus), el cual también será seguido en el tiempo.
“Dicho seguimiento está dirigido a poder evaluar si el sujeto se enferma o no después de haber completado 14 días del esquema de vacunación, lo que constituye la variable principal del estudio”, dijo la investigadora.
Los sujetos que reciban placebo, luego de haber terminado este periodo de seguimiento, van a ser vacunados con el mejor esquema que se haya identificado en el estudio.
“Ese es su beneficio personal, más allá de que sabemos que la contribución de cada una de las personas es a que Cuba pueda tener una vacuna. Hay muchas personas que nos han dicho, no importa si me ponen placebo, quiero estar porque el país necesita esta vacuna”, señaló.
¿Cómo se ha previsto el flujo del ensayo?
Lo primero que ya está ocurriendo es la identificación de los sujetos potenciales, la entrega a las personas de la hoja de información que necesitan conocer para consentir voluntariamente su participación en el estudio, lo cual incluye incluso el análisis con la familia, antes de firmar un documento como el consentimiento informado, requisito inviolable de todos los ensayos clínicos, refirió Toledo Romaní.
Una vez que esto ocurra, las personas van a ser evaluadas por el médico de la familia (evaluación inicial), donde este especialista define si el sujeto está apto y puede participar en el ensayo. “Todo este proceso ocurre en las áreas primarias de salud, donde se aplicará además una prueba de anticuerpos para evaluar que el sujeto no estuvo expuesto al virus con anterioridad aunque no se haya detectado, y como consecuencia tiene anticuerpos contra el SARS-CoV-2”, explicó.
Una vez que la persona tenga su consentimiento informado y su documento de evaluación, se elaborará en cada sitio clínico un cronograma que establece en qué momento le corresponde a la persona acudir al policlínico (sitio clínico) a recibir la vacuna.
Destacó que en estos sitios clínicos habrán médicos y enfermeras encargados de verificar estos criterios de inclusión y, en caso de cumplirlos, la persona adquirirá un código a partir de ese momento. Es decir, el número que tendrá durante todo el estudio y que representa el tratamiento a recibir.
“A partir de este número es que se asigna a uno de los tres grupos de tratamiento, que insistimos es a ciegas”, precisó.
Posterior a la aplicación de la vacuna, las personas serán observadas durante una hora en el sitio clínico, que dispondrán de un sistema de manejo de urgencias y emergencias con especialistas capacitados, para en caso de que se produjera algún evento adverso, los que hasta el momento no han ocurrido.
Los sujetos continuarán siendo observados luego por sus médicos de familia. Además, se les indica reportar cualquier evento o estado que sientan, incluso muy leve, pues cualquier detalle es importante.
A partir de este momento se hace el reporte al programa de vacunación y al sistema de vigilancia de eventos adversos sobre lo que se está produciendo, y ello se relaciona con la base de datos de vacunados existente.
Sin embargo, no solo se van a vigilar los eventos adversos. “Puede pasar que en el curso del ensayo, el sujeto apareciera como PCR positivo o se enfermara. En ese caso, también se ha previsto a partir del trabajo con el grupo nacional de expertos que ha trabajado en la pandemia, un protocolo de manejo diferenciado para estos pacientes que forman parte de los ensayos clínicos y tienen que ser seguidos para ver si desarrollan o no la enfermedad”.
Las personas tienen que tener la garantía de que pueden consentir y luego tomar la decisión de no seguir, y eso se respeta. “Se ha creado un comité de ética ampliado al cual se han vinculado todas las facultades de ciencias médicas de los municipios donde se han involucrado, para velar por estos elementos de los sujetos, y de los aspectos éticos que corresponden a la investigación”.
Todo este seguimiento se hará hasta que finalice el estudio, reafirmó.
Fase III de Abdala comenzará cuando la autoridad reguladora nacional lo autorice
La Dra. Verena Muzio González, directora de Investigaciones Clínicas del Centro de Ingeniería Genética y Biotecnología (CIGB), señaló que en el caso del candidato ABDALA “la estrategia de solapamiento ha permitido que comencemos la fase II tomando una decisión de la fase I, faltando aún algunos momentos para concluirlo, y de este mismo modo ocurrirá con la fase III”.
“Resulta significativo para nuestro país que, el mismo día en que Soberana 02 recibió su autorización para iniciar el ensayo fase III por el CECMED, nosotros estábamos entregando la documentación de solicitud de autorización de ensayo clínico, lo cual demuestra el intenso trabajo de Cuba en el desarrollo de vacunas”, destacó.
El ensayo fase III de Abdala comenzará cuando la autoridad reguladora nacional lo autorice, si bien se espera que sea en este mismo mes de marzo.
“Trabajamos para tener listas todas las condiciones requeridas, para en el momento que hayamos cumplido todas las exigencias del CECMED y este diese su autorización, no tener que esperar”, dijo Munzio González.
Fase III de Abdala: 42 mil sujetos de Guantánamo y Santiago de Cuba

El ensayo fase III de Abdala tendrá varios objetivos. Entre ello, demostrar la eficacia de la vacuna y su capacidad para proteger a los individuos vacunados en una proporción superior a los individuos que reciben el placebo. También busca evaluar la seguridad del inmunógeno, requisito durante todo el desarrollo del producto, al igual que lo relacionado con la respuesta inmune.
Señaló que se prevé incluir en el ensayo a 42 mil sujetos de las provincias de Guantánamo y Santiago de Cuba. Esta última provincia ya venía trabajando en el ensayo fase II por lo que ya existe experiencia y un grupo de investigadores capacitados.
“Coincidentemente, en el momento que empezamos a hacer el trabajo, Santiago de Cuba y Guantánamo junto a La Habana pasaron a ser las provincias con mayor incidencia de casos de la enfermedad en el país, por lo cual decidimos ampliar el ensayo a las mismas”, relató.
El sitio clínico principal es el hospital Saturnino Lora. Es un estudio multicéntrico, controlado con placebo, aleatorizado porque la persona no decide para qué grupo va y a doble ciegas. Están involucrados comités de ética de ambas provincias para la aprobación.
El diseño general del estudio contempla la administración de tres dosis separadas por 14 días. Una vez se obtenga la autorización de la agencia reguladora se inicia el proceso de captación, pre reclutamiento, consentimiento, precisó.
“Tenemos un reto enorme pero factible. Dado lo corto del esquema de vacunación de Abdala, queremos incluir esos 42 mil voluntarios en dos semanas. Tenemos el apoyo de las autoridades del gobierno, del partido, los consejos de defensa de ambas provincias, así como de las direcciones de salud pública y el resto de los involucrados”, dijo.
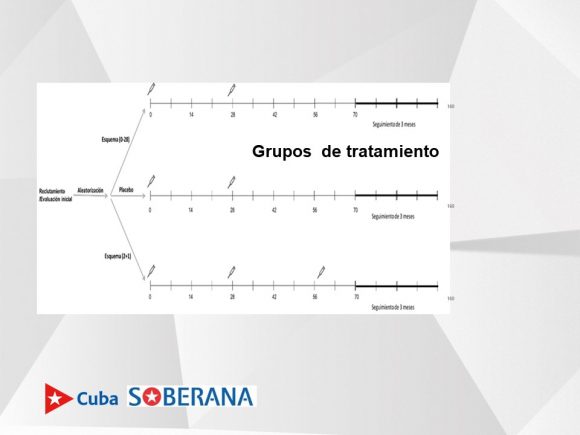
Pensamos establecer sitios de vacunación con horarios extendidos y existen sitios clínicos en los cuales habrá más de un vacunatorio, agregó. 14 días después de la última dosis comenzamos a evaluar la eficacia del producto.

En Guantánamo se incluyeron 5 áreas de salud que contemplan 12 mil individuos. Mientras, en Santiago de Cuba, además del hospital Saturnino Lora se trabajará en 13 áreas de salud con un alcance de 30 mil sujetos.
“Todo ello es posible también gracias a poder contar con un sistema productivo que, en el caso de Abdala, está integrado por el CIGB, centro productor del ingrediente farmacéutico activo, los laboratorios AICA, para la formulación, llenado y envase que cuenta con las capacidades de escalado necesarias. Todas las vacunas para la fase III ya están producidas”, concluyó.