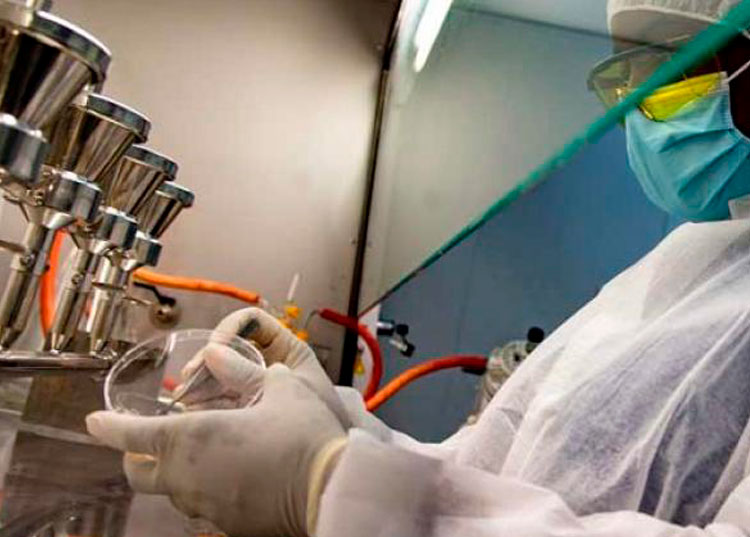
En el Centro Nacional de Biopreparados (BioCen), en la capital, se garantiza con buenas prácticas y seguridad la transferencia tecnológica de diversos medicamentos contra la COVID-19, que se elaboran en esa Empresa de Alta Tecnología.
Marco Antonio Álvarez Soto, jefe de su Departamento de Desarrollo de Bioprocesos, informó a la prensa que han transferido importantes productos como Jusvinza y el Interferón Alfa 2B Recombinante, del Centro de Ingeniería Genética y Biotecnología (CIGB); y el candidato vacunal Soberana 02, del Instituto Finlay de Vacunas (IFV).
De este último fármaco se lograron en las Plantas de Producción de Parenterales de BioCen las cantidades necesarias para su fase III de ensayos clínicos, gracias a la asimilación por los tecnólogos del centro del paquete documental y las informaciones facilitadas por el IFV.
En el caso del Interferón, el Máster en Ciencias se refirió al incremento de sus producciones, dada su efectividad en el protocolo contra el nuevo coronavirus, por lo cual el año pasado alcanzaron volúmenes superiores a lo usual en esa formulación.
También, el especialista comentó que ese proceso de traspaso incluye a productos del propio BioCen, como la Biomodulina-T, pues se adecua su traslado desde la Planta de Producción de Ingredientes Activos hasta las de Parenterales, donde culmina su composición.
Añadió que esta semana prevén comenzar la transferencia tecnológica del candidato vacunal Soberana Plus y próximamente trabajarán con el Soberana 01, ambos del IFV y claves en la estrategia del país en el enfrentamiento a la pandemia.
Esto supone un gran compromiso y son fundamentales la exactitud, el cuidado, y respetar cada etapa con vistas a un resultado exitoso, ya que de eso dependerá la materialización del esfuerzo de muchas personas, expresó Álvarez Soto.
Cuando una institución o laboratorio realiza los estudios en aras de desarrollar un nuevo producto y avanzan a la Fase III, necesita obtenerlo en lugares con buenas prácticas de fabricación, pues será lo más cercano a lo que saldrá completamente al mercado, precisó.
Agregó que al seleccionar el sitio, en este caso BioCen, solicitan la transferencia tecnológica, que comprende los pasos requeridos para obtener el medicamento, su proceso de formulación y las diferentes facetas productivas.
Dicho servicio también puede efectuarse cuando un centro asume la producción, pero quiere aumentar sus capacidades con vistas a obtener el producto a mayor escala, o si algún cliente desea una gran elaboración para un mercado determinado, detalló el experto.
Señaló que la duración de la transferencia depende de las características y la complejidad de los fármacos a transferir, y culmina cuando la producción se ha validado.
En aras de ello, continuó, producen cinco lotes y evalúan que hayan sido fabricados de forma consistente, y posteriormente el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos emite el autorizo final.
Álvarez Soto comenzó a trabajar en BioCen en 1992, y a partir de ese año hasta 1999 laboró en la transferencia tecnológica de la vacuna contra la Hepatitis B, desde el CIGB hasta la Planta de Ingredientes Activos, en aras de lograr una mayor producción a nivel nacional.